Elegir entre fabricantes de implantes subperiósticos y proveedores de implantes subperiósticos no es una decisión “de catálogo”. En subperiósticos, el margen para el error se reduce: hablamos de dispositivos altamente personalizados, con un ajuste crítico sobre el hueso, donde el proceso (diseño, fabricación, controles, documentación) pesa tanto como el material.
Por eso, cuando una clínica o un cirujano evalúa opciones, la pregunta real no es solo “¿qué producto es?”, sino “¿quién lo fabrica, con qué sistema de calidad, cómo se controla y cómo lo podré auditar si algo no cuadra?”. En este contexto, la trazabilidad no es un extra; es la forma de dormir tranquilo.
Southern Implants Ibérica trabaja con un enfoque que encaja bien con estas exigencias: criterios claros de calidad, documentación consistente y procesos orientados a la seguridad del paciente. Sin entrar en promesas absolutas, sí es razonable exigir a cualquier proveedor serio que pueda demostrar, con papeles y con procedimiento, cómo llega el implante desde la planificación hasta el quirófano.
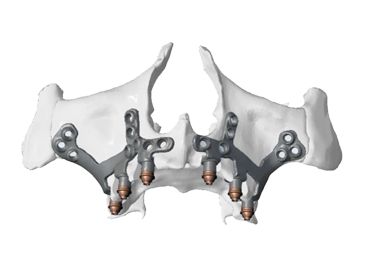
Qué hace diferente a un implante subperióstico en términos de calidad
Un subperióstico no se “elige”, se construye para un paciente. Eso cambia el tipo de riesgo y, por tanto, los controles necesarios.
El “por qué” técnico: dónde se juega la calidad de verdad
En un implante endoóseo estándar, gran parte del éxito se apoya en el protocolo quirúrgico y en la osteointegración. En subperiósticos, el éxito depende además de:
- Ajuste al hueso: pequeñas discrepancias pueden traducirse en puntos de presión, movilidad, inflamación o exposición.
- Diseño de apoyos y retenciones: una geometría mal resuelta puede comprometer estabilidad o higiene.
- Acabados superficiales: bordes, transiciones y pulidos influyen en el tejido blando y en el confort del paciente.
- Coherencia entre planificación y fabricación: lo diseñado debe ser lo fabricado, sin “interpretaciones” en el camino.
Cuando una clínica busca fabricantes de implantes subperiósticos, debería preguntar menos por “características” y más por cómo se garantiza que cada uno de esos puntos se controla y queda documentado.
Fabricante vs. proveedor: qué responsabilidades tiene cada uno
En el mercado es habitual que el interlocutor comercial sea un proveedor, pero el producto depende del fabricante. Y en dispositivos personalizados, esa diferencia importa.
Qué debe aportar un fabricante de implantes subperiósticos
Un fabricante sólido debería poder acreditar:
- Sistema de gestión de calidad específico para producto sanitario.
- Control de cambios y revisiones de diseño.
- Validación de procesos críticos (por ejemplo, fabricación aditiva o mecanizado, según el caso).
- Control de materiales y lotes.
- Registros de inspección y liberación del producto.
Qué debe aportar un proveedor de implantes subperiósticos
Un proveedor serio, además de distribuir, debería:
- Actuar como puente técnico: resolver dudas clínicas sobre flujo de trabajo, tiempos y documentación.
- Garantizar que la cadena documental (prescripción, diseño, fabricación, entrega) se mantiene íntegra.
- Gestionar incidencias con procedimientos claros (devoluciones, investigación, CAPA si aplica).
- Acompañar al equipo clínico en la preparación del caso (sin invadir la decisión médica).
En la práctica, lo ideal es que proveedor y fabricante estén alineados y que el proveedor —como Southern Implants Ibérica— no solo “sirva”, sino que se responsabilice del proceso de soporte.
Certificaciones y marcado: cómo leerlas sin quedarse en el sello
Las certificaciones no operan como una medalla; son un marco. Y lo que interesa no es “si existe un certificado”, sino qué implica en el día a día.
ISO 13485: una pista, no el final del camino
En producto sanitario, la ISO 13485 suele asociarse a sistemas de calidad. Para una clínica, el valor práctico está en preguntas como:
- ¿Hay registros de control para mi caso?
- ¿Se documentan no conformidades y acciones correctivas?
- ¿Se puede rastrear cada lote de material y cada paso del proceso?
Un proveedor serio debería ayudarte a aterrizar la certificación en documentación utilizable, no en un logotipo.
MDR / marcado CE: qué significa en la operativa
Cuando hablamos de comercialización en Europa, lo relevante para el usuario clínico es que exista conformidad regulatoria y que el dispositivo venga acompañado de documentación coherente (etiquetado, instrucciones, identificación, etc.). En dispositivos personalizados, además, el flujo documental suele ser más exigente: la clínica debe conservar información, y el fabricante debe mantener registros.
Si un proveedor de implantes subperiósticos evita hablar de documentación o no sabe explicarla, es una señal de alerta: el dispositivo puede ser técnicamente bueno, pero el sistema que lo sostiene quizá no lo sea.
Trazabilidad: la diferencia entre un “buen caso” y un proceso defendible
La trazabilidad es la capacidad de reconstruir la historia del implante: quién lo diseñó, con qué datos, qué material se empleó, qué controles se realizaron, cuándo se liberó y cómo se entregó.
Qué debería poder trazarse, sin excepciones
Una trazabilidad mínima razonable debería cubrir:
- Identificación del paciente/caso (de forma protegida y conforme a privacidad).
- Versión de archivos (DICOM/escaneos, STL, planificaciones).
- Iteraciones y aprobaciones de diseño.
- Material (tipo, lote, certificados).
- Proceso de fabricación (parámetros críticos y registros).
- Inspección final y criterios de aceptación.
- Etiquetado e identificación del implante entregado.
Para una clínica, esto se traduce en algo muy sencillo: si mañana hay una duda, ¿podemos demostrar qué se hizo y por qué?
Tabla útil: qué pedir y qué te dice cada documento
| Documento / evidencia | Qué te aporta | Señal de alerta si falta |
|---|---|---|
| Identificación única del implante (UDI u otro identificador) | Relación inequívoca implante–caso–documentación | No puedes rastrear incidencias con precisión |
| Certificado de material y lote | Control sobre origen y consistencia del material | “Es titanio, no te preocupes” sin soporte |
| Registro de inspección final | Verifica que se cumple el diseño y tolerancias | Solo “control visual” sin criterios definidos |
| Historial de versiones de diseño | Evita fabricar sobre un archivo antiguo | Cambios por WhatsApp sin control de revisión |
| Instrucciones de uso y etiquetado | Uso correcto y conservación documental | Entrega “sin papeles” o con documentación genérica |
Criterios de calidad que realmente importan al evaluar proveedores y fabricantes
Aquí es donde conviene bajar a tierra: si estás comparando fabricantes de implantes subperiósticos, estas son decisiones que tienen consecuencias directas en quirófano y en el postoperatorio.
1) Flujo de trabajo digital y control de versiones
El riesgo más común en casos personalizados no es “un mal implante”, sino una mala coordinación. El proveedor debería garantizar:
- Canal único para recepción de archivos.
- Confirmación de recepción y verificación de calidad de imagen/escaneo.
- Control de versión (qué archivo es el vigente).
- Validación de aprobación clínica antes de fabricar.
Cuando el proceso está bien definido, el caso fluye. Cuando no, aparecen retrasos, dudas y cambios de última hora que aumentan el riesgo.
2) Revisión de diseño con criterio clínico
Una revisión útil no es “te mando un render y listo”. Debe permitir evaluar:
- Zonas de apoyo y reparto de cargas.
- Espesores y transiciones.
- Perfilado de bordes.
- Espacios para higiene y tejidos blandos.
- Estrategia protésica (conexiones, emergencias, accesos).
Southern Implants Ibérica, como proveedor con orientación técnica, encaja especialmente bien cuando la clínica necesita una interlocución clara para iterar sin perder trazabilidad.
3) Control de acabados y ergonomía quirúrgica
Los acabados no son estética. Influyen en:
- Adaptación de tejidos blandos.
- Riesgo de irritación o exposición.
- Facilidad de inserción y ajuste intraoperatorio (cuando procede).
Pregunta directa que separa a los buenos: ¿qué criterios de acabado y aristas aplicáis y cómo se verifican?
4) Gestión de incidencias y aprendizaje del sistema
En medicina, lo importante no es solo evitar problemas, sino cómo se responde cuando algo no sale perfecto. Un proveedor maduro debería tener un proceso para:
- Registrar incidencias.
- Investigar causa raíz (cuando aplica).
- Proponer medidas correctivas/preventivas.
- Documentar y cerrar el caso.
Si ante una incidencia la respuesta es defensiva o informal, el sistema no está preparado.
Señales para decidir: cómo interpretar criterios sin simplismos
A veces dos opciones parecen “igual de buenas” hasta que miras los matices. Estas señales ayudan a tomar decisiones con menos sesgo.
Señales de confianza
- Documentación clara y entregada de forma consistente en cada caso.
- Capacidad de explicar el proceso sin ambigüedades.
- Tiempos realistas y comunicación proactiva.
- Diseño iterativo con control de versiones.
- Respuestas técnicas coherentes, sin prometer infalibilidad.
Señales de riesgo
- “Eso siempre sale bien” como argumento principal.
- Cambios de diseño por mensajes sueltos, sin registro formal.
- Falta de identificación única del implante.
- Documentación incompleta o genérica.
- Dependencia excesiva de una persona (“si no está X, no sabemos”).
Paso a paso: cómo evaluar un proveedor para tu primer caso subperióstico
Si vas a iniciar colaboración (o quieres auditar la que ya tienes), este flujo te da control sin convertirlo en un “máster” administrativo.
1) Define tu estándar mínimo documental
Antes de pedir presupuestos, decide qué vas a exigir siempre: identificación del implante, registros clave, instrucciones, historial de versiones. Esto reduce fricciones después.
2) Solicita un ejemplo real de dossier (anonimizado)
Pide ver cómo llega el caso “cerrado”: qué documentos incluye, cómo se identifican, cómo se archivan. Un buen proveedor lo tiene preparado.
3) Evalúa el circuito de diseño y aprobaciones
Asegúrate de que está claro:
- quién aprueba (y cómo queda registrado),
- cuántas iteraciones son habituales,
- qué pasa si cambia un archivo de imagen/escaneo.
4) Revisa criterios de fabricación e inspección
No necesitas el detalle industrial completo, pero sí entender:
- qué controles se hacen,
- qué se considera aceptable,
- cómo se libera el producto para entrega.
5) Alinea expectativas post-quirúrgicas y de seguimiento
Define desde el principio cómo se gestionan dudas, ajustes protésicos y feedback clínico. Es el punto donde se construye una relación a largo plazo.
Errores típicos (con ejemplos) y cómo evitarlos
Los fallos más costosos suelen ser de proceso, no de intención.
Error 1: arrancar con un caso complejo sin validar el flujo
Ejemplo: una clínica con poca experiencia en subperiósticos inicia con un caso con múltiples condicionantes protésicos y escaneo irregular. El proveedor recibe archivos incompletos, se retrasa la iteración y la planificación se vuelve confusa.
Cómo evitarlo: empieza con un caso “controlable” y usa ese primer caso para estandarizar el circuito de envío, revisión y aprobación.
Error 2: aprobar un diseño sin revisar higiene y tejidos blandos
Ejemplo: el diseño encaja bien sobre hueso, pero deja zonas difíciles de higienizar y perfiles que comprometen tejido blando. A las semanas, el paciente refiere molestias e inflamación localizada.
Cómo evitarlo: en la revisión de diseño, reserva un bloque específico para higiene, accesos y contornos, no solo ajuste óseo.
Error 3: cambios de última hora sin control de versión
Ejemplo: se envía un nuevo archivo tras una repetición de escaneo, pero el equipo no confirma la versión usada y se fabrica sobre el archivo anterior.
Cómo evitarlo: exige confirmación escrita de “archivo vigente” y un número de versión en cada entrega. Un buen proveedor lo incorpora al flujo de forma natural.
Mini-casos realistas: cómo se ve un buen proceso en la práctica
Caso 1: clínica que prioriza documentación desde el primer día
Una clínica decide trabajar con un proveedor que entrega un dossier estructurado por caso. Al tercer caso, el equipo ya tiene un protocolo interno: dónde se guarda cada versión, quién aprueba y qué se revisa en cada reunión. Resultado: menos dudas, menos correos y decisiones más rápidas.
Caso 2: iteración de diseño con foco en tejidos blandos
En un paciente con tejido fino, el equipo clínico solicita una segunda revisión centrada en bordes y transiciones. El proveedor propone pequeños ajustes de geometría y deja registro de cada cambio aprobado. El postoperatorio es más confortable y el mantenimiento higiénico se planifica mejor.
Caso 3: incidencia menor gestionada con método
Tras la intervención, surge una observación sobre un punto de apoyo que conviene mejorar en futuros casos similares. El proveedor registra el feedback, lo analiza y propone una medida preventiva para próximas planificaciones. No se trata de “culpas”, sino de aprendizaje del sistema.
Qué esperar a continuación: tiempos, entregables y criterios de decisión
Cada caso es distinto, pero el patrón suele repetirse: recepción de información, propuesta de diseño, iteraciones, aprobación, fabricación, inspección final y entrega. Lo que marca la diferencia es que el proveedor pueda anticiparte qué entregables recibirás en cada fase y qué criterios se aplican para pasar a la siguiente.
Si estás valorando a Southern Implants Ibérica como partner, tiene sentido pedir desde el inicio que te expliquen su circuito de trabajo: no para complicarlo, sino para que el equipo clínico sepa qué esperar y cómo integrarlo en su rutina.
Preguntas frecuentes (FAQ)
¿Qué diferencia hay entre fabricantes de implantes subperiósticos y proveedores de implantes subperiósticos?
El fabricante es quien diseña/fabrica bajo un sistema de calidad y asume responsabilidades técnicas del producto. El proveedor actúa como interlocutor, gestiona el flujo de trabajo y la documentación, y facilita soporte clínico y logístico.
¿Qué certificaciones debería pedir una clínica?
Más que “pedir sellos”, conviene pedir evidencias: sistema de calidad en producto sanitario, conformidad regulatoria aplicable en Europa, documentación por caso y capacidad de auditoría. Lo útil es lo que se puede demostrar con registros.
¿La trazabilidad es solo el lote del material?
No. En personalizados, la trazabilidad incluye también archivos, versiones de diseño, aprobaciones, parámetros de fabricación/inspección y la identificación del implante entregado. Es la historia completa del dispositivo.
¿Qué documentación debería acompañar a un implante subperióstico?
Como mínimo, identificación clara del implante, instrucciones y etiquetado, y documentación que permita relacionar caso–diseño–fabricación–entrega. Si además hay historial de versiones y registro de inspección, mejor.
¿Cómo puedo comparar dos proveedores si ambos “parecen profesionales”?
Pide un dossier de caso anonimizado, revisa el control de versiones y la claridad del circuito de aprobaciones. El proveedor que mejor explique el proceso y entregue documentación consistente suele reducir riesgos en clínica.
¿Qué debo revisar en la propuesta de diseño antes de aprobar?
Ajuste al hueso, zonas de apoyo, transiciones y bordes, espacios para higiene, relación con tejidos blandos y coherencia protésica. Y, sobre todo, que la aprobación quede registrada con versión y fecha.
¿Qué hago si detecto una incidencia tras la cirugía?
Documenta el hallazgo y comunícalo por el canal formal del proveedor. Lo recomendable es que exista un proceso de investigación y cierre, con medidas preventivas para futuros casos cuando proceda.
¿Tiene sentido empezar con un caso “fácil”?
Sí. Un primer caso controlado sirve para validar el flujo de archivos, la comunicación, la revisión de diseño y los entregables. Después es más sencillo escalar a casos complejos con seguridad operativa.

